Verteilung und Austausch von Kationen im Grenzbereich zwischen Bodenpartikel und Bodenlösung
Elektrische Ladung der Bodenpartikel
Von besonderer Bedeutung für die Mineralstoffernährung der Pflanzen aus dem Boden sind die im Porenwasser gelösten und die teilweise an Bodenpartikel gebundenen Ionen. Dies trifft besonders auf Kationen zu. Dabei spielen die elektrischen Ladungsverhältnisse im Grenzbereich zwischen fester und flüssiger Phase des Boden-Mikrogefüges mit Korngrößen < 2 µm (siehe Grafik „Mikrogefüge“) eine entscheidende Rolle. Die meisten Bodenpartikel sind auf ihrer Oberfläche negativ geladen. Dies trifft besonders auf die im Rahmen chemischer Verwitterung des primären Grundgesteins neu entstandenen Tonminerale zu. Sie weisen im Kristallgitter durch den isomorphen Ersatz von Si4+ durch Al3+ (siehe Kapitel „Struktur Feldspat“, „Struktur Glimmer“, „Struktur Tonminerale“) permanent und vom pH-Wert unabhängig eine negative Ladung auf. Durch ihre Schichtstruktur besitzen Tone zudem eine sehr große Oberfläche und damit eine hohe Ladungsdichte. Eine große Oberfläche bilden auch die Huminstoffe. Huminsäuren und Fulvosäuren sind besonders durch ihre Caboxylgruppen und phenolischen OH-Guppen ebenfalls geladen. Allerdings ist die Art der Ladung pH-Wert abhängig und damit variabel. Bei einem höheren pH-Wert werden H+-Ionen abgespalten und der organische Rest weist negative Ladungen auf. In saurem Milieu werden Protonen angelagert und es entstehen auch positive Ladungen. Bei saurem bis schwach saurem Bodensäuregehalt überwiegen die negativen Ladungen. Auch die Sesquioxide im Boden weisen, den Huminstoffen ähnlich, pH-Wert abhängige variable Ladungen auf.
Ionenverteilung im Grenzbereich von fester und flüssiger Bodenphase
Im Bodenporenwasser sind eine Reihe von Ionen gelöst, die in der Lösung diffundieren und sich möglichst gleichmäßig verteilen, u.a. die Kationen Ca2+, Mg2+, K+, Na+, Al3+, NH4+, H3O+ und die Anionen NO3-, SO42-, Cl-, HCO3- in unterschiedlicher Konzentration. Gleichzeitig werden die Ionen von den Ladungsstellen der Bodenpartikel angezogen und als Gegenionen zum Ladungsausgleich elektrostatisch angebunden. Die Stärke der Anziehung von Gegenionen durch die Bodenpartikel hängt von deren Ionenradius, Ladungsdichte, Wertigkeit und Größe des Hydratmantels ab. Deshalb nimmt die Bindungsstärke folgendermaßen ab: Al3+ > Ca2+ > Mg2+ > K+ = H+ > Na+. Die auszutauschenden Ionen sind an den drei Austauschergruppen nicht gleichermaßen zu finden. Die Erdalkaliionen Ca2+ und Mg2+ haften besonders im Bereich der Huminstoffe.
In Abbildung 59 ist eine Modellvorstellung zur Ionenverteilung dargestellt. Es wird ersichtlich, dass die Stärke der Anhaftung von Kationen im Grenzbereich der festen und flüssigen Phase mit der Entfernung von den geladenen Bodenpartikeln schnell abnimmt. Im Anschluss an die Doppel-Ionenschicht (Sternschicht) am unmittelbaren Grenzbereich folgt eine diffuse Schicht geringerer Anziehung der Kationen, aber noch mit positivem Ladungsüberschuss. Diese geht in den Bereich gleichmäßiger Ionenverteilung mit Ladungsausgleich über. Außerdem spielen bei der Ionenverteilung die gegenseitige Abstoßung gleichsinniger Ladungen und die Konzentration der Ionenlösung eine Rolle.
Ionenaustausch im Grenzbereich von fester und flüssiger Bodenphase
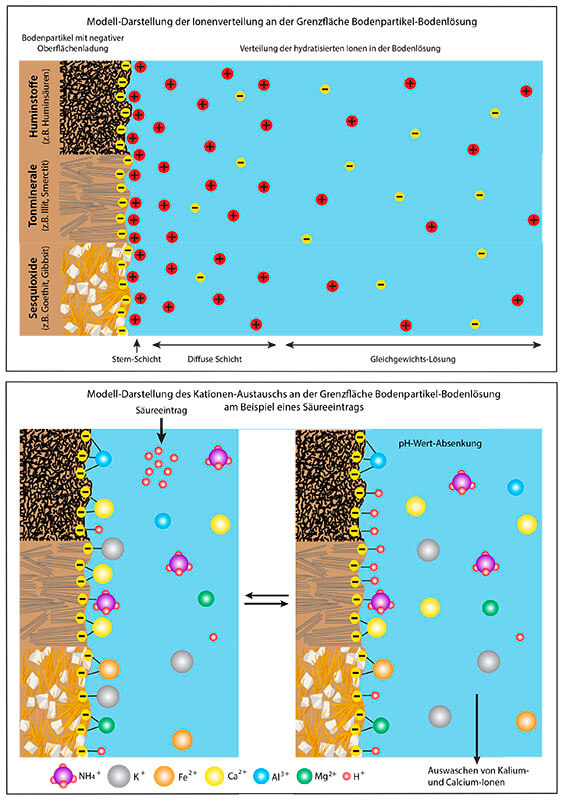
Zwischen den diffundierenden Ionen der Bodenlösung und den durch die geladenen Bodenartikel adsorbierten Ionen an der Grenzschicht besteht eine reversible Austauschbeziehung. Allerdings kann der Austausch nur durch ladungs- und wertungsgleiche Ionen, meist Kationen, aus der dem festen Austauscher nahen Bodenlösung erfolgen. Eine Modelldarstellung zum Prinzip des Ionenaustausches am Beispiel eines Säureeintrags von außen, z.B. durch sauren Regen, ist in Abbildung zu entnehmen.
In sauren Böden sind an den Austauschern besonders sauer wirkende Al3+- und H+-Ionen adsorbiert, in schwachsauren bis basischen Böden besonders basisch wirkende Erdalkali- und Alkali-Ionen. Diese können bei einem Säureeintrag von außen durch sauren Regen mittels ihres Austauschs gegen H+-Ionen eine plötzliche stärkere Versauerung abpuffern (siehe Kapitel „Bodensäuregehalt“). Ist durch länger andauernde Säureeinwirkung die Austauschmöglichkeit und damit die Pufferwirkung zum größten Teil erschöpft, werden die ausgetauschten basisch wirkenden Ionen durch Niederschläge und Sickerwasser zu einem großen Teil ausgewaschen. Es kommt zur Entbasung des Bodens. Dies zeigen die Messwerte entlang des Braunerde-Bodenprofils im Rumbecker Holz (siehe Kapitel „Kationengehalt“).
Die Gesamtheit der austauschbaren Kationen wird als „Kationen-Austauschkapazität KAK“ bezeichnet. Die KAK gibt Hinweise auf das Vorhandensein wichtiger pflanzenverfügbarer mineralischer Nährstoffe in einem Bodenbereich. Die Austauchkapazität bei dem jeweils an der Mess-Stelle vorhandenen pH-Wert nennt man „effektive KAK“. Diese wurde bei der Bestimmung des Kationengehalts im Boden des Rumbecker Holzes gemessen (siehe Kapitel „Kationengehalt“).
Ionenaustausch zwischen Pflanzen und Boden
Die Adsorption der Kationen an den Boden-Austauschern ist für die mineralische Ernährung der Pflanzen aus dem Boden von entscheidender Bedeutung. Die für die Pflanzen besonders wichtigen Kationen K+, Ca2+, Mg2+ und Fe2+ stellen in adsorbiertem Zustand eine Nährstoffreserve dar, die von der Pflanze durch Ionenaustausch aktiv genutzt werden kann. Im Bereich der Wurzelhaare produziert die Pflanze H+-Ionen, zum einen durch die Abgabe von CO2 in die Bodenlösung, wo sich Hydrogencarbonat HCO3- und H+ bildet, zum anderen durch Abgabe organischer Säuren, die in den Säurerest R-COO- und H+ dissoziieren. Die zusätzlichen H+ -Ionen diffundieren zu den Bodenpartikeln mit adsorbierten Kationen und können dort gegen diese getauscht werden (siehe Abbildung 80b ). Die losgelösten Kationen diffundieren zusammen mit anderen Ionen entlang eines Diffusionsgefälles mit Wasser passiv aus der Bodenlösung in die äußeren Wurzelrindenzellen. Im Inneren der Wurzel erfolgt durch aktive Ionenkanäle eine Selektion der benötigten Ionen. Von besonderer Bedeutung für die mineralische Ernähung der Pflanzen sind die symbiontischen Mycorrhiza-Formen.